Transformation, transfection, transduction은 유전공학을 공부하면서 처음 배울 때 가장 헷갈리는 용어 중 하나이자 절대로 잊어서는 안 되는 용어입니다. 유전공학에서 가장 중요한 기술 중 하나는 PCR일 것이고, 다른 하나는 오늘 정리할 유전자 도입의 method들이라고 감히 말할 수 있을 것 같습니다. 오늘은 이러한 용어들에 대해 간략히 알아보겠습니다.
글의 시작에 앞서 요약하자면 오늘 볼 세 용어는 아래와 같이 정리할 수 있습니다.
- Transformation (형질전환): non-viral DNA을 박테리아에 도입하는 것
- Transfection (형질주입): non-viral DNA (혹은 RNA)를 진핵세포(특히 mammalian cell)에 도입하는 것
- Transduction (형질도입): viral DNA를 세포(bacterial or mammalian cell)에 도입하는 것
이 세 용어는 어떠한 DNA를 어디에 도입시키냐에 따라 달라지는 개념입니다 (참고로 덧붙이자면, 형질전환, 주입, 도입과 같은 번역은 번역자나 연대에 따라 달라지기는 경우가 더러 있어 영문용어를 사용하는 편이 혼란이 없습니다)
1. Transformation (형질전환)
정의
Transformation은 일반적으로 non-viral DNA를 bacterial cell에 도입하는 것을 말합니다. 정확히는 포유류 세포(mammalian cell)이 아닌 세포 [박테리아(bacteria), 효모(yeast), 식물세포(plant cell), 균류(fungi)]에 대한 DNA의 도입을 의미하는데 그 중 E.coli에 대한 유전자 도입이 가장 흔하게 활용되고 있는 만큼 일반적으로 박테리아에 대한 유전자 도입의 의미로 사용되고 있습니다.
목적
Transformation은 다양한 목적으로 사용되지만 일반적으로는 plasmid DNA를 증폭하기 위한 목적이나 유전자 클로닝(cloning)을 위해 사용합니다. Plasmid는 박테리아에 도입되면 박테리아의 DNA 복제기구 (DNA replication machinery)를 이용하여 자가 복제를 시작하는데, 이를 이용해 원하는 plasmid를 대량으로 생산할 수 있습니다. 이와 같은 원리로 박테리아나 효모로 하여금 원하는 단백질을 대량생산하는 것도 가능하기 때문에 각종 산업과 연구에서 응용되고 있습니다.
방법
박테리아에 대한 DNA도입은 다양한 방법으로 이루어지지만 대표적인 두 갈래를 보자면 전기를 이용한 전기천공법(electroporation)과 화학적 처리법(chemical method)이 있습니다.
- 전기천공법(electroporation): 전기자극으로 nanopore 형성 후 DNA를 도입
- 화학적 처리법(chemical method): 화학적 처리(CaCl2, DMSO, MgCl2, PEG, RbCl 등)를 통한 chemically competent cell 제작과 열충격(heat shock)을 이용한 DNA도입
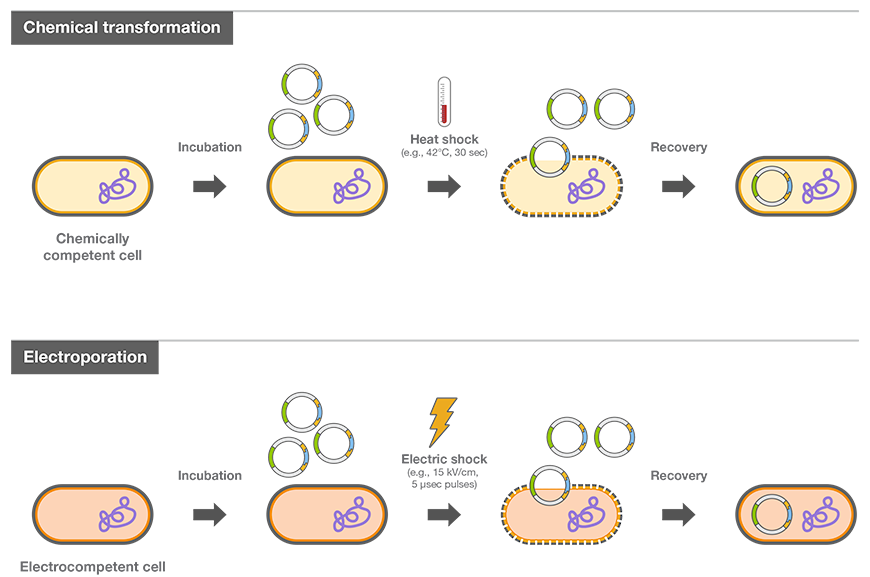
특히 후자인 화학적 처리법 중 CaCl2를 사용하는 CaCl2법은 현재 가장 일반적으로 사용되고 있는 방법으로, 많은 Biotech 회사에서 컴피턴트 셀(chemically competent cell)로 제품화되어 판매되고 있습니다. Chemically competent cell은 별도의 기계장치나 번거로운 실험과정이 필요 없기 때문에 비용도 저렴하고, 실험 방법이 간단해져 누구든 한 번만 배우면 쉽게 형질전환을 수행 할 수 있게 됐습니다. 일반적인 실험 방법은 아래와 같습니다.
- -80’C에 보관되어 있는 competent cell을 4’C에서 천천히 녹인 뒤 도입할 plasmid DNA 첨가
- 4’C에서 15-30min 배양 후 42’C에서 30-90sec 배양 (heat shock)
- Heat shock 후 4’C에서 1min 배양 (stabilization)
- Stabilization 후 37’C에서 30-60min 배양
- Antibiotics(ampicillin, kanamycin 등) 첨가된 LB plate에 도말 (spreading)
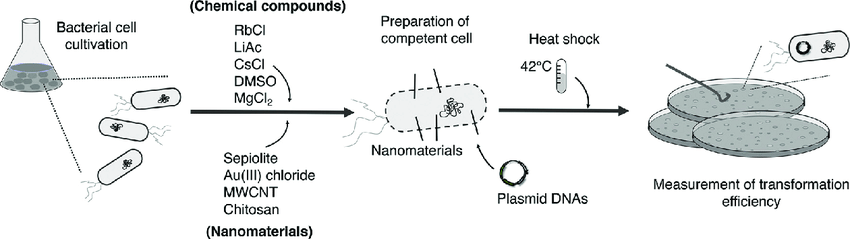
최근에는 이러한 실험 과정에서 Heat shock이나 heat shock후 incubation 과정을 생략할 수 있는 제품들이 개발되어 실험 과정을 더욱 간단하고 신속하게 만들었습니다. 이 ‘competent cell’이라는 주제는 더 할 이야기가 있을 것 같으니 다음 포스팅에서 마저 정리해보겠습니다.
2. Transfection (형질주입)
정의
Transfection은 앞선 머리말에서 ‘mammalian cell’에 대한 핵산의 도입이라 표현했으나 정확히는 진핵세포(eukaryotic cell)에 대한 핵산(nucleic acid)를 의미합니다. 다만 yeast와 같은 예외가 있기 때문에 현대에는 사실상 mammalian cell에 대한 핵산의 도입이라는 의미로 사용되고 있습니다 (yeast는 진핵생물이긴 하나 단세포생물이고 transfection이 아닌 transformation을 수행한다고 표현합니다).
목적
Bacterial나 yeast에 대한 핵산의 도입은 주로 플라스미드 등의 증폭이나 그 산물의 ‘대량 생산’에 초점을 맞추고 있지만 mammalian cell에 대한 transfection은 일반적으로 유전자의 기능에 대한 연구 목적으로 흔히 사용되고 있습니다. 플라스미드 DNA나 siRNA 등의 도입을 통해 특정 유전자의 과발현이나 결손을 유도하고 그 표현형을 분석하는 것이 현재까지 가장 많이 사용되고 있는 유전자 연구 방법이지요. 물론 원핵생물이나 하등 진핵생물에서 생산할 수 없는 특수한 대사산물을 생산하기 위해 인간세포나 동물세포에 유전자를 도입하기도 하는데, 이러한 산물들은 산업적으로 매우 중요한 위치에 있기 때문에 이 또한 transfection의 주목적이라고 할 수 있습니다.
방법
동물세포에 대한 유전자 도입은 화학적 방법(chemical method)와 비화학적 방법(non-chemical method)로 크게 분류할 수 있습니다. 화학적 방법은 핵산을 특수한 물질에 포장하여 도입시키는 방법이라고 이해하면 쉬운데, 일반적으로 세포막과 유사한 liposome을 이용하는 방법이 흔히 사용됩니다.
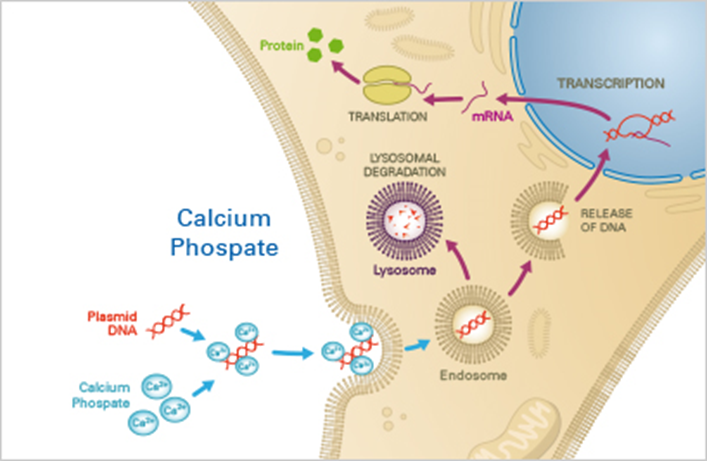
Chemical method
- CaPO4(Calcium phosphate)법: 박테리아에서 CaCl2를 사용하는 것처럼 CaPO4를 사용하여 DNA를 세포에 도입함
- Cationic polymer: DEAE-dextran, polyethylenimine(PEI) 등을 이용, DNA의 음전하를 상쇄하여 endocytosis를 통해 세포 내로 유입되게 함
- Lipofection: 세포막과 유사한 liposome에 핵산을 포장하고 liposome이 세포막과 융합되는 성질을 이용해 핵산을 도입
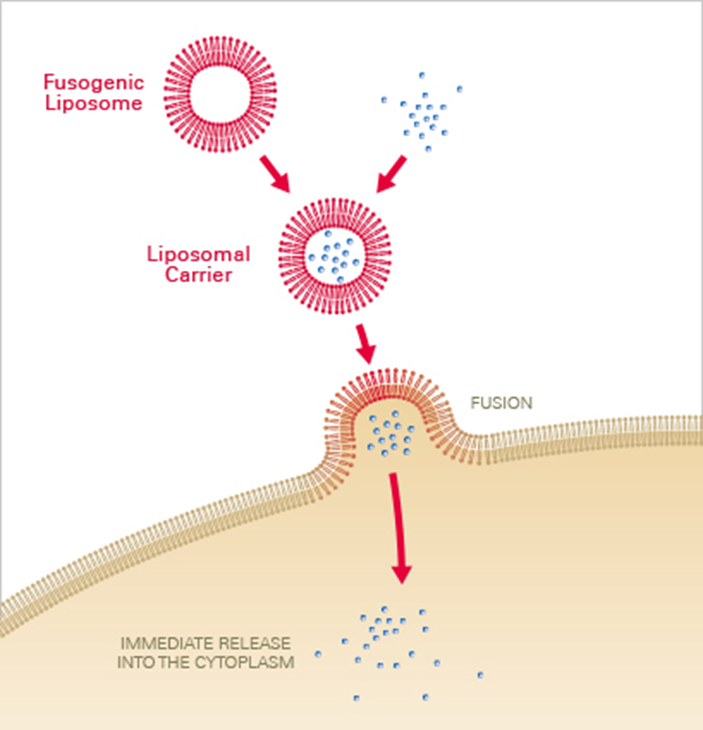
Non-chemical method
- Electroporation: 전기자극(electric pulse)을 통해 세포막에 nanopore를 형성, 핵산을 도입함
- Sonoporation: 초음파를 사용하여 세포막에 pore를 형성, 핵산을 도입함
- Microinjection: 주사를 통해 핵산을 세포핵에 직접 주입
- Biolistics (particle bombardment): nanoparticle(e.g. gold-nanoparticle)과 핵산을 결합하여 세포에 쏘는 방법(gene gun)으로 도입, magnetic nanoparticle과 핵산을 결합하여 자기장을 통해 도입하는 방법 등 DNA를 세포에 입자와 함께 직접 세포에 주입하는 방법
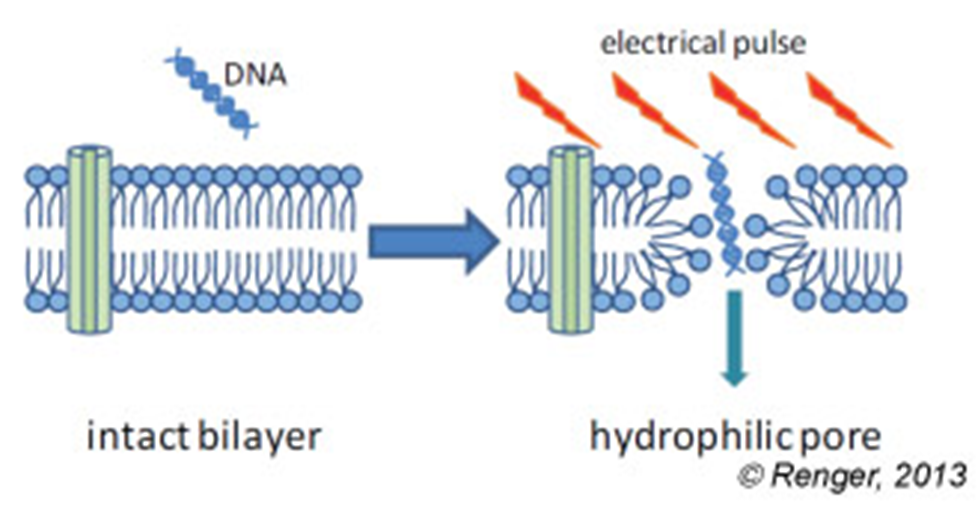
외에도 많은 방법이 존재하지만 현대에는 세포에 가장 적은 데미지를 주면서 높은 효율로 핵산을 도입하는 방법으로 lipofection과 electroporation이 사용되고 있으며, 특히 lipofection은 실험에 별다른 장비도 필요 없고 적은 비용으로 많은 transfection이 가능하기 때문에 실험에 가장 흔히 이용되고 있습니다. 세포에 따라 transfection에 필요한 method도 달라지기 때문에 본인이 사용할 세포에 가장 적합한 method와 material을 선정하는 것이 중요합니다.
3. Transduction (형질도입)
정의
바이러스를 사용하여 외래DNA를 세포에 도입하는 방법을 의미합니다. Transduction은 바이러스의 일종인 bacteriophage가 박테리아를 감염시킬 때 유전자가 전달되는 현상을 통해 발견되었는데요, 이 때문에 처음에는 박테리아에 유전자를 전달할 때 이용됐지만 현재는 CaCl2법 같이 훨씬 저렴하고 효율적인 방법들이 개발됨에 따라 박테리아에 대해서는 일반적으로 사용하지 않고 있습니다. 따라서 일반적인 의미에서 transduction은 바이러스(혹은 viral vector)를 사용하여 동물세포에 유전자를 도입하는 방법을 의미한다고 할 수 있습니다.
목적
외래DNA를 세포에 도입시키는 것이기 때문에 기본적으로 transfection과 동일한 목적으로 사용된다고 할 수 있습니다. 다만 viralvector를 사용하는 경우 살아있는 동물(혹은 인간)에 적용할 수 있고, 일반적으로 transfection이 어려운 세포에도 유전물질을 전달할 수 있기 때문에 transfection과 목적은 동일하나 다른 대상(subject)에 대한 method라고 할 수 있습니다 (lipofection과 같은 방법도 동물에서 사용할 수 있기 때문에 transfection이 동물에서 적용할 수 없다는 것은 아니고 일반적으로 동물실험in vivo에서 transduction이 사용된다는 의미입니다).
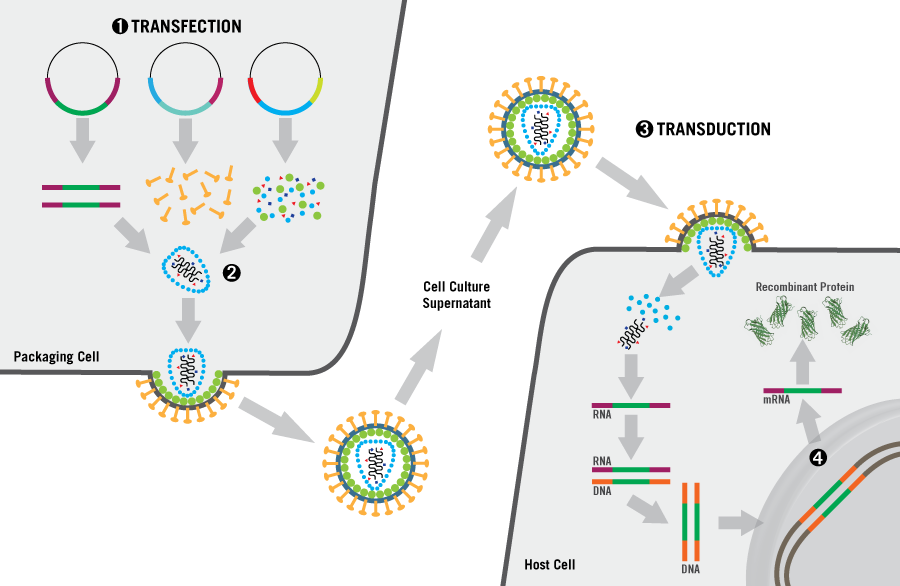
방법
Transduction은 도입하고자 하는 유전자를 가지고 있는 virus 혹은 viral vector를 제작하고 이를 세포에 감염시키는 것이 전부입니다. 이 과정에서 중요한 것은 어떤 viral vector를 사용하여 세포를 감염시키냐는 것인데요, 바이러스의 종류에 따라 감염시킬 수 있는 세포의 종류와 감염 이후 DNA가 영구적으로 지속되느냐 일시적으로 지속되느냐가 결정되기 때문입니다.
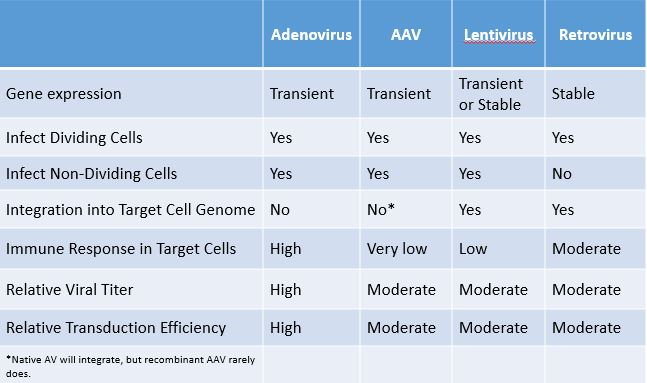
- Retrovirus: RNA virus이며 복제된 핵산이 핵막(nuclear envelope)을 통과할 수 없어 활발하게 분열하는 dividing cell에만 적용 가능하다(분열 과정에 핵막이 소실되기 때문). Host genome에 integration되기 때문에 외래DNA가 세포에 영구적으로 남게 된다
- Lentivirus: RNA virus이며 복제된 핵산이 핵막을 통과할 수 있어 dividing cell과 non-dividing cell(e.g. neuron 등)에 모두 적용 가능하다. Host genome에 integration되기 때문에 외래DNA가 세포에 영구적으로 남게 된다
- Adenovirus: DNA virus이며 host genome에 삽입되지 않기 때문에 일시적인 유전자 발현만 가능하다
- 그 외 Adeno-associated virus (AAV), Sendai virus (SeV) 등이 사용됨
실험에 사용할 대상(종, 세포의 종류)과 목적(영구/일시적 발현)이 정해졌다면 이에 적합한 바이러스를 결정하고 실험을 진행하면 됩니다. 실험은 간단히 바이러스의 생산과 감염 두 단계로 나누어 볼 수 있는데, 바이러스 생산에 특화된 HEK293A, HEK293T, HEK293FT 세포주 등을 사용하여 바이러스를 생산하고 여기에서 만들어진 바이러스를 정제하여 transduction할 세포에 감염시킴으로써 유전자의 도입을 수행합니다.
간단히 정리하려고 했는데 역시 정리하다보면 생각보다 분량이 많이 늘어나는데요...
여전히 competent cell이나 transduction 등에 대한 중요한 내용들이 남아 아쉬움이 남습니다.
지난번에 정리했던 stem cell도 이어서 정리하지 못하고 있는데 오늘 글도 일단은 마무리하고 시간이 나는데로 천천히 추가해보겠습니다.
감사합니다.





댓글